
Echilibrul/dezechilibrul forței musculare periferice în controlul binar neurologic al funcției și disfuncției vezicii urinare
Caseta de evidențiere
Key findings
• Controlul vezicii urinare este binar, echilibrat, cu componente corticale si periferice.
Ce se știe și ce este nou?
• Nu există conceptul de control periferic al vezicii urinare.
• Controlul periferic echilibrat al vezicii urinare. Forțele mușchilor pelvieni se contractă împotriva ligamentelor pentru: (I) închiderea uretrei; (II) deschide-l; (III) întindeți vaginul pentru a preveni incontinența urgentă.
What is the implication and what should we change now?
• Leziunile ligamentelor slăbesc mușchii contractându-se împotriva lor pentru a dezechilibra sistemul și a provoca disfuncții I, II, III de mai sus.
• O schimbare în gândire care recunoaște că disfuncțiile I, II, III de mai sus sunt potențial vindecabile prin repararea ligamentelor pelvine adecvate.
Introduction
Pentru mine a fost întotdeauna evident că, în general, motivul din spatele incontinenței urinare feminine trebuie căutat în afara vezicii urinare, de exemplu. de exemplu, în structurile care susțin uretra și gâtul vezicii urinare - în special ligamentele, mușchii podelei pelvine și vaginul. Dacă simptomele incontinenței urinare apar dintr-o anatomie disfuncțională în structurile menționate mai sus, atunci funcția ar trebui să vină odată cu restaurarea anatomiei.”—Profesor Axel Ingelman -Sundberg, Institutul Karolinska, 1990.
1990 Adresa URL a teoriei integrale: https://obgyn.onlinelibrary.wiley.com/toc/16000412/1990/69/S153
Patogenia incontinenței de urgență, chiar și astăzi, se spune că este necunoscută. Definițiile Societății Internaționale de Continență (ICS) din 1976 au adus o oarecare ordine în haosul existent anterior pentru incontinența de stres și de urgență. Înainte de aceasta, îndemnul era denumit în mod diferit “incontinență activă”, “neinhibată” sau “vezică hipertonică”, “vezică instabilă”.
Că controlul vezicii urinare este neurologic, nu este discutabil. Întrebarea este cum? Fiziologii timpurii au legat senzațiile de umplere a vezicii urinare cu nervii aferenti care merg de la vezică la măduva spinării și nervii eferenți care merg de la măduva spinării la vezică. Barrington a descris o serie de reflexe pentru micțiune (1). Feneley și Harrison au descris o multitudine de centri inițiatici și inhibitori în cortexul cerebral, puț, medular, cerebel, mesenencefal, ganglioni bazali și hipotalamus (2).
O scurtă viziune istorică
Din punct de vedere istoric, rolul circuitelor neurologice în funcția vezicii urinare, OAB și alte afecțiuni ale vezicii urinare a fost confuz și neclar. Fearnsides a descris “interferențe complete și incomplete” cu puterea de a reține urina atât pe “partea efector, cât și pe partea aferentă” (3). În timpul studiilor cistometrice efectuate de Parker și Rose (4), au fost observate modele caracteristice similare cu cele găsite cu leziuni neurologice. Lapides et al. a descris “vezica neurogenă dezinhibată” la un grup de pacienți care prezentau simptome de urgență, frecvență și miccțiune precipitată, dar nicio dovadă de tulburare neurologică (5). Lapides et al. a atribuit astfel de tulburări dezvoltării incomplete a integrării cerebrale, așa cum se întâmplă la un copil mic. Aceste modele au fost descrise ca “ disfuncție detrusor disinergică ” de Hodgkinson și colab. (6), “vezică psihogenă” de Youssef (7), și “vezică neinhibată” de Ingelman -Sundberg (8). Aceste studii au introdus concepte conform cărora cauza incontinenței de urgență ar putea fi neurologică sau chiar psihologică, unele dintre ele fiind actuale astăzi.
Controlul cortical al vezicii urinare a fost descris de Griffiths în 2004 (9). “Simptomele precum vezica hiperactivă (OAB) reprezintă tulburări ale controlului vezicii urinare. Scanarea funcțională a creierului prin tomografie cu emisie de pozitroni (PET) și imagistica prin rezonanță magnetică funcțională (RMN) sugerează că un control normal este exercitat de o rețea de regiuni din sistemul nervos emoțional, inclusiv gri periaqueductal, talamus, insula, cingulatul anterior și cortexul prefrontal.”
Întrebarea cu astfel de scanări este: “Ce măsoară ele?” Griffiths consideră “OAB” (urgență) doar ca fiind cauzată “de o rețea de regiuni din sistemul nervos emoțional” (9). Cu toate acestea, o explicație pur corticală, așa cum este postulată de Griffiths, nu poate explica vindecarea simptomelor OAB prin repararea ligamentelor, care a fost raportată de mai multe studii chirurgicale la multe sute de femei (10-18). Paradigma Teoriei Integrale (ITP) interpretează “iluminarea” zonelor creierului detectate de scanările corticale ca un exces de impulsuri aferente de la receptorii de întindere “N”, în ciuda tuturor încercărilor de a le suprima de către sistemele de control, corticale (Figura 1, săgeată albă) și periferice (Figura 1, săgeți roșii mari).
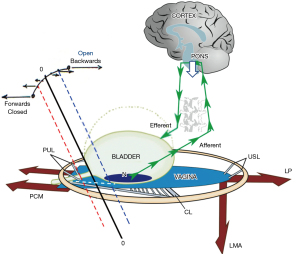
Controlul vezicii urinare este binar, din exteriorul vezicii urinare
Controlul feedback-ului există în toate sistemele naturale și poate fi exprimat prin formule matematice simple (19). Vezica instabilă, prin definiție, are dificultăți în a menține starea închisă în timpul umplerii și astfel se balansează inadecvat în starea deschisă.
În 1993, s-a demonstrat urodinamic, că vezica urinară era un reflex de micțiune activat prematur (20) reglat printr-un sistem de control cu feedback binar, cu două componente anatomice, corticale și periferice (musculo/ligamentar) (21). Închiderea a fost statul dominant. Când vezica urinară era plină și femeia era gata să micționeze, starea de “închidere” s-a oprit în mod reflex, iar starea “deschisă” a dominat, golindu-se printr-un reflex micțional activat.
Control binar cortical
Sistemele centrale facilitatoare și inhibitoare, prezente în toate părțile creierului (2), acționează ca niște gardieni booleeni, deschizând sau închizând porțile (Figura 2) pentru impulsurile neurologice, pe măsură ce trec în sus și în jos prin sistemul nervos central, în funcție de indiferent dacă sistemul de micţiune este în stare deschisă sau închisă.
Control binar periferic
La o femeie normală, un mecanism sensibil de control neurologic musculoelastic periferic (Figura 1), menține continența: pe măsură ce vezica urinară se umple, receptorii de întindere și de volum “N” sunt stimulați, iar presiunea uretrală crește în mod reflex datorită unei “contracții musculare extrinseci” simultane. (Figura 1, săgeți mari) (22). Cele trei forțe ale mușchilor pelvieni opuse, controlate cortical, acționează echilibrat, cu forță rezultată nulă la nivelul colului vezicii urinare (10). Vezi p.20, Acta URL: https://obgyn.onlinelibrary.wiley.com/toc/16000412/1990/69/S153 (also, see Video S1).
Este necesară o elasticitate adecvată în zona gâtului vezicii urinare a vaginului “zona de elasticitate critică” (ZCE), pentru a permite acțiunile separate ale forțelor musculare opuse. Orice cicatrice la ZCE poate lega aceste forțe pentru a dezechilibra sistemul pentru a provoca pierderi masive de urină (10) (a se vedea Acta URL pp.8,12,14,15,16,19,21).
Corecția chirurgicală a sistemului de control perifericm
Aproximativ 10 milioane de operații de sling miduretral (MUS) între 1996 și 2018 prin repararea ligamentelor pubouretrale (PUL), vindecarea simptomelor OAB (impuls, frecvență, nicturie) prin repararea ligamentului uterosacral (USL) (15-18), susțin substanțial Descoperirea teoriei integrale de bază din 1990, că controlul continenței și micțiunii nu a fost de la vezica în sine, ci din exteriorul vezicii urinare, în principal de la mușchii pelvieni care se contractau împotriva ligamentelor suspensoare competente (Figura 1) (10). Teoria integrală a afirmat că ligamentele laxe, cu deficit de colagen au cauzat prolaps și disfuncții ale vezicii urinare: închidere [incontinență urinară de efort (SUI)]; evacuare (retentie); deficit de control al reflexului micțional (OAB) (10). Aceste afirmații au fost validate chirurgical prin vindecarea SUI (11,12), și a defectului sfincterian intrinsec (13) cu MUS (11-13). Vindecarea următoarelor afecțiuni cu o sling USL a validat în continuare predicțiile Teoriei Integrale: OAB (frecvență, impuls, nicturie) (14,15), cistita interstițială/sindrom de durere a vezicii urinare (16), prolaps de gradul 3 și 4 (17), retenție urinară și “vezică subactivă” (UAB) (18).
Închidere normală echilibrată a uretrei (continență)
Pentru controlul impulsului, PONS (săgețile albe în jos) blochează direct impulsurile aferente de la receptorii de întindere urotelială “N” (Figura 1). În plus, impulsurile eferente corticale activează în mod egal ambele forțe ale mușchilor pelvieni care acționează în mod opus (săgeți mari): mușchiul pubococcigian (PCM), placa levator (LP), mușchiul longitudinal comun al anusului (LMA). Mușchii întind membrana vaginală în mod egal, ca o trambulină, pentru a susține “N” de jos, cu forța rezultată zero (0-0) la nivelul colului vezicii urinare (vezi Video S1). Pentru controlul pierderii de urină la tuse, creierul simte venirea tusei și trimite un semnal către mecanismul periferic pentru a închide uretra cu 0.25 secunde înainte de înregistrarea tusei, pentru a crește presiunea uretrală (2). Echilibrul de forțe se modifică și 0-0, în Figura 1, se deplasează înainte spre linia roșie întreruptă pentru a închide uretra, crescând presiunea uretrală.
Dezechilibrarea normală a deschiderii uretrei (micțiune)
Dezechilibrarea normală a sistemului are loc numai în timpul micției, când vezica urinară este plină și trebuie evacuată (Figura 1). După cum este ilustrat în Figura 1, presiunea hidrostatică a urinei apasă pe receptorii de întindere urotelială “N” pentru a activa impulsuri aferente către cortex de la “N”. Într-un punct critic, reflexul micțional este activat, iar femeia simte “pofta de a merge”. Dacă este convenabil de golit, cortexul dă un semnal pentru ca sistemul binar să intre în faza “deschisă”, iar punctul de echilibru 0-0 se deplasează înapoi spre liniile albastre întrerupte verticale. Inhibarea corticalei reflexe (săgeata albă) este eliberată. Periferic, vectorul înainte (PCM) se relaxează, vectorii înapoi (LP/LMA) întind vaginul înapoi și în jos pentru a deschide peretele uretral posterior (linii albe întrerupte sub uretra) în pregătirea contracției detrusorului care golește vezica urinară (10).
Dacă nu se poate goli
Dacă golirea este incomod, cortexul dă un semnal pentru ca sistemul să intre în faza “închisă”, indicat de liniile roșii întrerupte din Figura 1. Inhibarea corticală (săgeata albă) suprimă impulsurile aferente din “N”. Impulsurile eferente se îndreaptă către mușchii pelvieni cu acțiune opusă indicați de săgețile mari din Figura 1 pentru a închide uretra și pentru a întinde vaginul ca o trambulină pentru a preveni semnalele aferente de la “N”, activând necorespunzător reflexul de deschidere (micțiune).
Dezechilibrarea disfuncțională a forțelor musculare
Simplist, PUL-urile slabe dezechilibrează sistemul binar, astfel încât echilibrul său se mută la linia albastră, modul “deschis” (incontinență) (Figura 1). Cu USL slabe, balanța se mută la linia roșie, modul “închis” (reținere). Conform Teoriei Integrale (10) ligamentele slabe sau laxe sunt cauza principală a dezechilibrului în sistemul binar. Cu referire la Figura 1, (simplist) PCM contractează împotriva PUL; contractul LP/LMA împotriva USL. PUL slabe dezechilibrează sistemul binar, astfel încât echilibrul său se mută la linia albastră, modul “deschis” (incontinență de efort) și, de asemenea, îndeamnă, dacă PCM nu poate întinde vaginul suficient de înainte pentru a susține receptorii de întindere “N”. Cu USL slabe, dacă PUL și PCM sunt sănătoase, balanța se deplasează la linia roșie, modul “închis” pentru a provoca retenția urinară caracteristică sindromului Fowler și UAB. Aceeași slăbiciune USL poate împiedica LP/LMA să întindă vaginul înapoi pentru a susține “N”, astfel încât “N” se declanșează la un volum mic al vezicii urinare pentru a activa prematur micțiunea [OAB, hiperactivitate a detrusorului (DO)], explicând modul în care OAB și UAB poate coexista.
OAB și DO
În 1993, s-a demonstrat urodinamic că OAB și DO sunt identice cu o micțiune activată prematur, dar altfel normal (20). Cu referire la Figura 1, bazată pe sistemul binar de control (21), ceea ce se numește acum ca OAB (impuls, frecvență, nicturie) sau “instabilitatea detrusorului urodinamic” (acum DO) este o consecință a unui defect anatomic într-o anumită parte. a sistemului de control prin feedback (Figura 1). Defectul anatomic, fie că era central sau periferic, a dezechilibrat sistemul, astfel că a oscilat între stările “deschis” și “închis” (21). Această stare instabilă a fost numită “instabilitate detrusor” în trecut, acum “OAB”. Cu referire la sistemul binar (Figura 1), PUL sau USL slabe slăbesc forțele musculare care întind vaginul pentru a susține receptorii de întindere “N”; “N” declanșează impulsuri aferente care activează reflexul micțional; modul “deschis” domină temporar, iar acest lucru este experimentat ca “îndemn”. Când reflexul de închidere își recapătă controlul, reflexul micțional este suprimat, iar nevoia se diminuează.
Model de conformitate scăzut
Un model de complianță scăzut la testarea cistometrică indică faptul că reflexul micțional a fost activat, dar este suprimat cu succes de cortex (21) (Figura 1, săgeți albe în jos). S-a demonstrat urodinamic că un test de spălare a mâinilor1 poate elibera inhibiția corticală, astfel încât punctul de echilibru 0-0 al sistemului este împins în “fază deschisă” (Figura 1, linii albastre întrerupte), ducând la contracția detrusorului și pierderea de urină (20,21).
Inchidere mecanica dezechilibrata (incontinenta urinara de efort)
În timpul testării urodinamice, pacientului i se cere să tușească. Cu 0,25 secunde înainte ca tusea să fie înregistrată (23), cortexul trimite un semnal către mecanismul de control periferic unde este activat reflexul de închidere. Cu referire la Figura 1, PCM cu acţiune înainte închide uretra distală (10). Dacă PUL-urile sunt slabe, la fel este și forța PCM care se contractă împotriva lui. Echilibrul forțelor musculare se pierde; 0-0 se deplasează înapoi la faza “deschisă” (Figura 1, linii albastre întrerupte). Ca o consecință, LP/LMA trage baza vezicii urinare înapoi/în jos și uretra este deschisă (Figura 1, linii albe întrerupte sub uretra); rezistenta uretrale la curgere este scazuta exponential (Legea lui Poiseuille) si urina se scurge la tuse.
Incontinență “mixtă”
Până la 70-80% dintre femeile cu IUE au incontinență “mixtă”, stres și impuls. O cauza specifică pentru impuls se adaugă la cea pentru SUI: tensiunea vaginului sub “N”, necesită contribuții egale de forță musculară atât din partea PCM, cât și a LP/LMA (“efectul trambulină”) (Figura 1). Aceleași PUL-uri libere care provoacă SUI, slăbesc vectorul forward, PCM, care contractează forward împotriva acestuia; vaginul nu poate fi întins suficient pentru a susține “N” de jos; în consecință, “N” poate declanșa impulsuri aferente pentru a provoca impuls în plus față de SUI.
Deschidere mecanică dezechilibrată (retenție urinară)
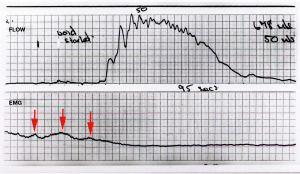
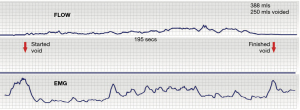
Deschiderea mecanică dezechilibrată poate duce la simptome de UAB sau retenție urinară (18). Cu referire la Figura 1, atunci când este gata să mictureze, cortexul semnalează sistemului să treacă de la faza 0-0 stabilă închisă la faza “deschisă” (linii albastre întrerupte), PCM se relaxează, LP/LMA deschide tubul de evacuare uretral; electromiografia (EMG) și diagrama de flux sunt normale (Figura 2). Dacă USL sunt slabe, forțele vectorului înapoi, LP/LMA, care se contractă împotriva USL slăbesc și nu pot deschide în mod adecvat peretele urthral posterior. Detrusorul trebuie să se contracte împotriva unei uretre (relativ) nedeschise și este perceput de femeie ca “micțiune obstrucționată”, cu un EMG tipic și diagramă de flux (Figura 3).
Cu referire la Figura 1, sindromul Fowlers (24) și UAB sunt explicate după cum urmează (18): USL-urile sunt slabe în mod congenital, ceea ce slăbește LP/LMA care se contractă împotriva lor. Mușchii (relativ) mai puternici cu contracție lentă înainte (PCM) trage vaginul și punctul de echilibru 0-0 înainte spre liniile roșii întrerupte. Acest dezechilibru de forțe supratensează vaginul distal și închide uretra distală mai strâns așa cum este raportat în sindromul Fowler (24), astfel încât întinderea înainte creează un suport mai ferm sub receptorii de întindere urotelială “N”. Ca urmare a bazei mai ferme create sub “N”, este nevoie de o presiune hidrostatică mai mare, (un volum mai mare al vezicii urinare) pentru a activa impulsurile aferente din “N” astfel încât să inițieze reflexul micțional. Aceasta explică volumele mai mari ale vezicii în repaus, retenția, timpii de golire lenți raportați în UAB și sindromul Fowler (25).
Urmărirea urinară sau reținerea de la anomalii în circuitul neurologic binar
În circuitul neurologic normal, ilustrat în Figura 1, nervii aferenți din “N” sunt activați prin presiunea hidrostatică a vezicii urinare pentru a transmite impulsuri către creier. Nervii eferenți transmit impulsuri de la cortex care instruiesc sistemul de control musculo-ligamentar periferic să închidă uretra, să o deschidă sau să întindă vaginul pentru a susține “N” și a preveni activarea prematură a reflexului micțional, care este simțit ca “impuls”.
Stimularea receptorilor uroteliali de întindere “N”, printr-o leziune locală, fie că este vorba de un fibrom cervical apăsat asupra vezicii urinare, a bazei, a infecției vezicii urinare, a cancerului urotelial, poate trimite impulsuri aferente excesive către cortex(Figura 1, mici săgeți verzi), care sunt interpretate ca îndemn. Odată atinsă o masă critică, impulsurile activează reflexul micțional pentru a determina golirea vezicii urinare (incontinență de urgență). Odată activată, mecanica micției preia controlul: PCM se relaxează, ceea ce permite LP/LMA să deschidă “pâlnia” uretrei (Figura 1, linii albe întrerupte), iar detrusorul se contractă pentru a se goli.
Inhibarea corticală blocată, fie că este vasculară (accident vascular cerebral), tumoră sau scleroză multiplă (SM), poate permite trecerea nestingherită a impulsurilor aferente către centrul de micție pentru a activa micțiunea, provocând scurgeri necontrolate de urină. Nervii eferenți deteriorați, de exemplu, de SM, pot preveni activarea mecanismului de control periferic și, de asemenea, pot duce la scurgeri constante de urină. Prevenirea stimulării aferente de la “N” (Figura 1), prin MS sau secțiunea măduvei spinării, poate duce la retenție urinară.
Manifestări urodinamice ale sistemului binar cu incontinență de urgență
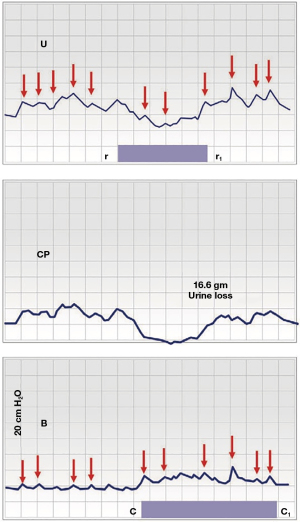
Figura 4 este un grafic urodinamic cistometric. Modelul fazic al “DO” urodinamic poate fi explicat ca o bătălie pentru dominație prin cele două moduri ale sistemului binar, “închis” (Figura 1, linie roșie) și “deschis” (Figura 1, linie albastră). Odată ce reflexul micțional (modelul DO) este activat de creier, presiunea de închidere a uretrei proximale (PC) scade (de la r la r1), iar, câteva secunde mai târziu, în “B”, vezica urinară începe să se contracte (de la c. până la c1) (20,25). Umplerea rapidă forțată a vezicii urinare (100 mL/minut) trimite impulsuri aferente rapide de la “N” către creier și se activează reflexul de închidere; vectorul înainte, PCM, se contractă înainte în mod repetat pentru a închide uretra distală (Figura 4, săgeți mici roșii). Între timp, reflexul micțional este stimulat continuu de impulsuri aferente rapide de la “N” (Figura 1). La “r”, modul binar “deschis” a devenit temporar dominant; echilibrul de forțe a trecut de la “închis” la “deschis” și s-au pierdut 16,6 g de urină; la r1, modul “închis” a recăpătat dominația, CP a crescut. Modelul urodinamic fazic din Figura 4, “U”, “CP”, care caracterizează “DO”, poate fi explicat anatomic după cum urmează: există o întârziere de 3-8 secunde în sistemul de control al feedback-ului aferent/eferent (Figura 1) între presiunea scăzută, unde domină reflexul micțional, și presiunea ridicată, unde predomină reflexul de închidere (21). Intervalul de timp necesar pentru a trece de la modul “închis” la modul “deschis” este exprimat ca un model fazic pe graficele de înregistrare, “U” și “CP”, în Figura 4. Picurile de presiune (săgeți roșii) care sunt active pe tot parcursul, indică contracții repetate ale mușchiului striat pelvin pentru a închide uretra (sub direcția reflexului de închidere).
Retenția urinară de la anomalii ale circuitului neurologic
Prevenirea semnalelor aferente de la receptorii de întindere “N” care ajung în cortex, de exemplu, prin leziuni MS în calea aferentă de la “N” la centrul de micție, poate preveni activarea micțiunii pentru a provoca retenție urinară. Detrusorul trebuie să se contracte împotriva unui tub uretral nedeschis. Echilibrul de forțe se deplasează permanent înainte la “închis” (Figura 1, linie roșie). Secțiunea măduvei spinării va separa atât căile aferente, cât și căile eferente (Figura 1, săgeți verzi) pentru a provoca retenție urinară, cel puțin inițial.
Pierderea masivă de urină de la gâtul vezicii urinare cicatrice, sindromul vaginului legat (TVS)
Cu referire la Figura 1, cicatrizarea în zona gâtului vezicii urinare a vaginului (între liniile întrerupte verticale roșii și albastre), ia elasticitatea necesară pentru ca forțele musculare opuse (Figura 1, săgeți roșii mari), să funcționeze separat; țesutul cicatricial “lega” forțele pelvine posterioare mai puternice, LP/LMA de forțele anterioare, PCM, și poate depăși PCM la efort. Echilibrul de forțe se balansează rapid în spate; peretele uretral posterior este tras cu forța spre deschidere cu pierderi masive de urină. Există două cauze distincte ale unui TVS cicatrici, afectarea iatrogenă și fistula obstetrică. Cicatricele iatrogenice suficiente pentru a provoca TVS, pot apărea după repararea vaginală “nativă”, prin foi de plasă mare și prin colposuspensie Burch. Simptomul tipic este pierderea masivă de urină care apare imediat la ridicarea din pat dimineața. Scurgerea continuă zi/noapte după repararea cu succes a fistulei obstetricale este atribuită TVS (26), legarea forțelor musculare opuse prin cicatrizarea masivă a fistulei. O grefă de piele aplicată în zona gâtului vezicii urinare a vaginului este curativă atât pentru manifestările iatrogene, cât și pentru fistulele obstetrice ale TVS. Utilizarea preventivă a lamboului Singapore în operația de fistulă obstetrică a dus la o uscăciune îmbunătățită dramatic, mai ales atunci când este efectuată la femeile care continuă să piardă cantități masive de urină după închiderea cu succes a fistulei (26).
Mușchi sau ligamente, care este principala patogeneză?
Planșeul pelvin funcționează într-un mod holistic. Cu referire la Figura 1, ligamentele, mușchii, circuitele neurologice, nervii somatici și viscerali lucrează holistic pentru a controla cortical vezica urinară și anorectul. Deoarece mușchii afectați nu pot fi vindecați chirurgical, ratele ridicate de vindecare raportate pentru disfuncțiile vezicii urinare/intestinului/durerii/prolapsului prin repararea ligamentului pelvin indică faptul că ligamentele pelvine sunt cele mai vulnerabile dintre diferitele părți ale sistemului de control (13-18). Acest lucru a fost demonstrat în mod direct într-un experiment cu 47 de biopsii ale mușchilor pelvini orbi la femei cu IUE (27), care aveau o operație de MUS. Slingul a vindecat 89% din IUE a doua zi, în ciuda dovezilor de leziuni musculare severe anterioare în marea majoritate a biopsiilor musculare. Cu toate acestea, reparațiile ligamentelor MUS nu vindecă niciodată 100% din simptomele pelvine. Prin urmare, este rezonabil să se atribuie cel puțin unele dintre remediile eșuate ale simptomelor în urma reparațiilor ligamentelor leziunii musculare găsite, de exemplu, în studiul orb (28) și studiile neurologice anterioare ale lui Swash și colab. (28).
Cum să rezolvi leziunile musculare striate?
Exercițiile pentru podeaua pelvină pe bază de ghemuit ale Patriciei Skilling întăresc cei trei mușchi pelvieni reflexi și ligamentele împotriva cărora aceștia se contractă. Ei au îmbunătățit simptomele individuale ale vezicii urinare/intestinului/durerii cu 50% la 60-90% dintre (mai ales) femeile aflate în premenopauză (29). Ele pot fi folosite preoperator și postoperator pentru a întări mușchii striați pelvieni, dar funcționează cel mai bine la femeile aflate în premenopauză.
Rolul mușchilor netezi în funcționare și disfuncție
Deși accentul în această lucrare a fost pus pe interacțiunile coordonate controlate cortical ale ligamentelor și mușchilor striați, contracția longitudinală a mușchilor netezi (în special) a vaginului, a vezicii urinare și a uretrei este considerată ca fiind importantă pentru controlul vezicii urinare (30). Vedem mușchiul neted al organelor lucrând în mod reflex (și corespunzător) în coordonare cu sistemul de control binar atât în timpul închiderii, cât și al urinării (31,32). Pentru urinare, vaginul posterior și peretele uretral posterior acționează ca o trapă deschisă înainte de micțiune de către LP/LMA (Figura 1). Pentru continența în timpul efortului, PCM (Figure 1) trage peretele vaginal distal contractat înainte ca o trapă pentru a închide uretra distală din spate.
Concluzii
Defectele anatomice oriunde în sistemul binar pot altera controlul periferic, neurologic al forțelor musculare prin deplasarea punctului de echilibru 0-0 înainte sau înapoi pentru a provoca disfuncții de deschidere sau închidere. Ligamentele și vaginul sunt cele mai vulnerabile la naștere și vârstă, deoarece colagenul este principala lor componentă structurală. În mod clar, totuși, mușchii pelvieni afectați trebuie să joace și un anumit rol în disfuncțiile vezicii urinare, deoarece a fost amplu demonstrat că și ei pot fi deteriorați la naștere.
Mulțumiri
Dorim să ne exprimăm recunoștința editorilor profesor Peter Petros și Vani Bardetta pentru sprijinul excepțional acordat în proiectarea și rafinamentul articolului.
Finanțare: Niciuna.
Footnote
Provenința și evaluarea de la egal la egal: Acest articol a fost comandat de către Societatea Internațională pentru Pelviperineologie pentru seria “Paradigma Teoriei Integrale” publicată în Annals of Translational Medicine. Peter Petros (Redactor) și Vani Bardetta (Redactor adjunct) au fost editori invitați neplătiți ai seriei. Articolul a fost supus unei evaluări externe.
Fișier de evaluare inter pares: Disponibil la https://atm.amegroups.com/article/view/10.21037/atm-23-1771/prf
Conflicte de interese: Toți autorii au completat formularul de divulgare uniformă ICMJE (disponibil la https://atm.amegroups.com/article/view/10.21037/atm-23-1771/coif). The series “Integral Seria “Paradigma Teoriei Integrale” a fost comandată de către Societatea Internațională de Pelviperineologie fără nicio finanțare sau sponsorizare. Autorii nu au alte conflicte de interese de declarat.
Declarație etică: Autorii sunt responsabili pentru toate aspectele lucrării, asigurându-se că întrebările legate de acuratețea sau integritatea oricărei părți a lucrării sunt investigate și rezolvate în mod corespunzător. Toate procedurile clinice descrise în acest studiu au fost efectuate în conformitate cu standardele etice ale comitetelor de cercetare instituționale și/sau naționale și cu Declarația de la Helsinki (așa cum a fost revizuită în 2013). A fost obținut consimțământul informat scris de la pacienți pentru publicarea acestui articol și a imaginilor însoțitoare. Participarea umană la videoclip s-a făcut cu permisiunea pacientului, pe baza faptului că a fost deidentificat.
Declarație de acces deschis: acesta este un articol cu acces deschis distribuit în conformitate cu licența internațională Creative Commons Attribution- NonComercial - NoDerivs 4.0 (CC BY-NC-ND 4.0), care permite replicarea și distribuirea necomercială a articolului cu strictețe cu condiția ca nu se fac modificări sau editări și că lucrarea originală să fie citată în mod corespunzător (inclusiv link-uri către publicarea oficială prin DOI relevant și licență). Consultați: https://creativecommons.org/licenses/by-nc-nd/4.0/.
1O atingere este deschisă pentru ca femeia să audă. Ea se spală pe mâini într-un castron în timpul cistometriei.
References
- Barrington FJF. The component reflexes of micturition in the cat. Part III. Brain 1941;64:239-43. [Crossref]
- Feneley RCL, Harrison SCW. Urinary continence and micturition. In: Henry MM, Swash M. editors. Colpoproctology and the Pelvic Floor. 2nd ed. Oxford: Butterworths Heinermann; 1992:98-111.
- Fearnsides EG. The innervation of the bladder and urethra. Brain 1917;40:149-86. [Crossref]
- Parker MM, Rose DK. Inhibition of the bladder. Arch Surg 1937;34S:828-38. [Crossref]
- Lapides J, Ajemian EP, Stewart BH, et al. Physiopathology of stress incontinence. Surg Gynecol Obstet 1960;111:224-31. [PubMed]
- Hodgkinson CP, Ayers MA, Drukker BH. Dyssynergic detrusor dysfunction in the apparently normal female. Am J Obstet Gynecol 1963;87:717-30. [PubMed]
- Youssef AF. Sphincter incontinence in the female: a new approach to its classification, diagnosis and treatment. Acta Obstet Gynecol Scand 1957;36:439-59. [Crossref] [PubMed]
- Ingelman-Sundberg A. Urinary incontinence in women excluding fistulas. Acta Obstet Gynecol Scand 1952;31:266-91. [Crossref] [PubMed]
- Griffiths DJ. Cerebral control of bladder function. Curr Urol Rep 2004;5:348-52. [Crossref] [PubMed]
- Petros PE, Ulmsten UI. An integral theory of female urinary incontinence. Experimental and clinical considerations. Acta Obstet Gynecol Scand Suppl 1990;153:7-31. [Crossref] [PubMed]
- Ulmsten U, Petros P. Intravaginal slingplasty (IVS): an ambulatory surgical procedure for treatment of female urinary incontinence. Scand J Urol Nephrol 1995;29:75-82. [Crossref] [PubMed]
- Petros PE, Ulmsten UI, Papadimitriou J. The autogenic ligament procedure: a technique for planned formation of an artificial neo-ligament. Acta Obstet Gynecol Scand Suppl 1990;153:43-51. [Crossref] [PubMed]
- Nakamura R, Yao M, Maeda Y, et al. Retropubic tissue fixation system tensioned mini-sling carried out under local anesthesia cures stress urinary incontinence and intrinsic sphincter deficiency: 1-year data. Int J Urol 2017;24:532-7. [Crossref] [PubMed]
- Petros PE. New ambulatory surgical methods using an anatomical classification of urinary dysfunction improve stress, urge and abnormal emptying. Int Urogynecol J Pelvic Floor Dysfunct 1997;8:270-7. [Crossref] [PubMed]
- Liedl B, Inoue H, Sekiguchi Y, et al. Is overactive bladder in the female surgically curable by ligament repair? Cent European J Urol 2017;70:53-9. [PubMed]
- Goeschen K, Gold D, Liedl B, et al. Non-Hunner’s interstitial cystitis (IC) is different from Hunner’s IC and may be curable by uterosacral ligament repair. Urol Int 2022;106:649-57. [Crossref] [PubMed]
- Inoue H, Nakamura R, Sekiguchi Y, et al. Tissue Fixation System ligament repair cures major pelvic organ prolapse in ageing women with minimal complications - a 10-year Japanese experience in 960 women. Cent European J Urol 2021;74:552-62. [PubMed]
- Petros P, Abendstein B, Swash M. Uterosacral ligament repair improves urinary retention and other Fowler's syndrome descriptions. Cent European J Urol 2018;71:436-43. [PubMed]
- May RM. Simple mathematical models with very complicated dynamics. Nature 1976;261:459-67. [Crossref] [PubMed]
- Petros PE, Ulmsten U. Bladder instability in women: a premature activation of the micturition reflex. Neurourol Urodyn 1993;12:235-9. [Crossref] [PubMed]
- Papa Petros PE. Detrusor instability and low compliance may represent different levels of disturbance in peripheral feedback control of the micturition reflex. Neurourol Urodyn 1999;18:81-91. [Crossref] [PubMed]
- Lose G. Impact of changes in posture and bladder filling on the mechanical properties of the urethra in healthy and stress incontinent females. Neurourol Urodynam 1990;9:459-69. [Crossref]
- Constantinou CE, Govan DE. Contribution and timing of transmitted and generated pressure components in the female urethra. Prog Clin Biol Res 1981;78:113-20. [PubMed]
- Fowler CJ, Christmas TJ, Chapple CR, et al. Abnormal electromyographic activity of the urethral sphincter, voiding dysfunction, and polycystic ovaries: a new syndrome? BMJ 1988;297:1436-8. [Crossref] [PubMed]
- Tanagho EA. The anatomy and physiology of micturition. Clin Obstet Gynaecol 1978;5:3-26. [Crossref] [PubMed]
- Browning A, Williams G, Petros P. Skin flap vaginal augmentation helps prevent and cure post obstetric fistula repair urine leakage: a critical anatomical analysis. BJOG 2018;125:745-9. [Crossref] [PubMed]
- Petros PE, Swash M, Kakulas B. Stress urinary incontinence results from muscle weakness and ligamentous laxity in the pelvic floor. Pelviperineology 2008;27:107-109.
- Swash M, Snooks SJ, Henry MM. Unifying concept of pelvic floor disorders and incontinence. J R Soc Med 1985;78:906-11. [Crossref] [PubMed]
- Skilling PM, Petros P. Synergistic non-surgical management of pelvic floor dysfunction: second report. Int Urogynecol J Pelvic Floor Dysfunct 2004;15:106-10; discussion 110. [Crossref] [PubMed]
- Kato MK, Muro S, Kato T, et al. Spatial distribution of smooth muscle tissue in the female pelvic floor and surrounding the urethra and vagina. Anat Sci Int 2020;95:516-22. [Crossref] [PubMed]
- Petros PE, Ulmsten U. Role of the pelvic floor in bladder neck opening and closure I: muscle forces. Int Urogynecol J Pelvic Floor Dysfunct 1997;8:74-80. [Crossref] [PubMed]
- Papa Petros PE, Ulmsten U. Role of the pelvic floor in bladder neck opening and closure II: vagina. Int Urogynecol J Pelvic Floor Dysfunct 1997;8:69-73. [Crossref] [PubMed]
Editor: Traian Enache, Head of Surgical Gynaecology, Medicover Hospitals Bucharest, Romania
Translator: Rîbu Iuliana-Georgiana, Teacher of French and German and Founder of AstraLingua, Bucharest, Romania
(Acest text este doar pentru scopuri academice, conținutul real trebuie verificat cu versiunea originală în engleză.)


